イオン化傾向は語呂で覚える Li K Ca!
🤚 常温の水と反応するものもあれば、非常に強力な酸としか反応しないものなど、 元素の種類によってイオン化しやすさは全く異なっています。

🤚 常温の水と反応するものもあれば、非常に強力な酸としか反応しないものなど、 元素の種類によってイオン化しやすさは全く異なっています。

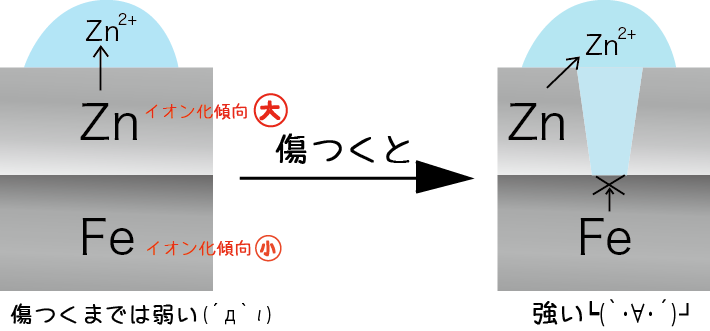
🚀 入試で使う範囲に関してイオン化傾向を並べると以下のようになります。 しかし、亜鉛 Zn を水 H 2 O と反応させると、亜鉛 Zn の表面には、不溶性の水酸化亜鉛 II Zn OH 2 が生じて、内部を保護するため、反応はすぐに止まってしまいます。
💙 本題に入る前に、基礎的な知識になるイオンについて確認しましょう。 Li K Ca Na Mg Al Zn Fe Ni Sn Pb H 2 Cu Hg Ag Pt Au 常温で速やかに反応 常温では徐々に反応 高温では速やかに反応 反応しにくい 反応しない 金属は酸化されると、その酸化被膜が金属と酸素 O 2 との接触を断ち、反応は途中で止まります。 それがコチラ。

🖐 6 沸騰水と反応するマグネシウム Mg イオン化傾向が中程度のアルミニウム Al や亜鉛 Zn 、鉄 Fe などは、高温の水蒸気とならば反応します。 勿論、はじめてイオン化傾向を学んだときに覚えておかなくても大丈夫な内容です。 電子を受け取った原子は負電荷に帯電して陰イオンとなり、電子を放出した方は正電荷に帯電して陽イオンとなる。
5
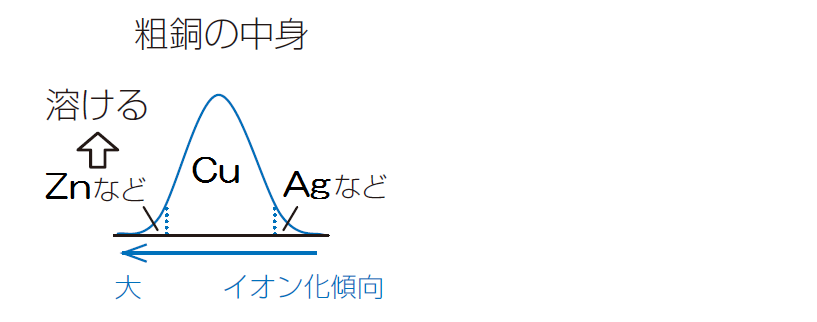
🤗 主な金属の標準電極電位を次の図. 原子のにより安定化の度合いが異なるので、励起に必要なイオン化エネルギーの値や、電子を受けとる際の安定化エネルギーであるの値は、元素の種類やイオン化の進行状況の違いによってそれぞれ異なるエネルギー値をとる。

👣 詳細は高校レベルを超えるので扱いませんが、 イオン化傾向とイオン化エネルギーは似ているけど全く異なるものととらえておいてください! もしイオン化エネルギーについて怪しいという方がいたら、 を見てくださいね! イオン化傾向の覚え方!語呂合わせで今スグ暗記! イオン化傾向の大きい金属から順に並べたものを、 金属のイオン化列といいます。 上の図の通り、リチウムはK殻に2つ,L殻に1つの電子を持つ元素でした。
18